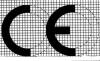2020-03-31 14:05:58 0
這幾天久違的醫用外科口罩漸漸能買到了,疫情終于緩和下來,但是國外疫情急轉直上的趨勢仍預示著這場全球性的疫情仍再蔓延,一罩難求的情景在國外不少國家繼續上演著。對于日產量超1.2億只的口罩生產大國來說,內需尚才稍緩,出口外需就接踵而來。最近有不少口罩企業詢問口罩出口認證事宜,小編總結如下幾點供參考:
一、美國口罩標準及認證要求
1、美國一次性醫用口罩認證要求:按照美國FDA醫療I類產品做認證(豁免510K的醫療器械),流程相對比較簡單為:
填寫申請表格-信息確認-取PIN碼-交付年費-下發注冊號-產品出口。
資料準備小貼士:申請人信息(包括公司名稱、地址、電話、聯系人、郵箱、網站等)和產品英文名稱即可 。
2、美國醫用外科口罩認證要求:按照美國FDA醫療II類做認證,流程較為復雜:
產品測試(性能測試、生物學測試-準備510K文件-提交FDA評審-FDA發10K批準信-完成工廠注冊和機器列名-產品出口。
資料準備小貼士:產品標識,包括企業包裝標識、使用說明書、包裝附件、產品標示、產品描述,包括產品的預期用途、工作原理、動力來源、零組件、照片、工藝圖、裝配圖、結構示意圖、標準規范、測試報告、軟件驗證資料等,這些都是必備的。
3、美國防護口罩N95及以上9種口罩認證要求:按照NIOSH(美國國家職業安全衛生研究所)認證標準(HHS, 美國衛生及公共服務部法規“42 CFR Part 84”)。
送樣品至NIOSH實驗室實施測試-同時提交技術性資料(包括質量體系部分資料)至NIOSH文審-文審和測試都通過后-NIOSH核發批文-產品出口。
二、歐盟口罩標準及認證要求
1、歐盟一般防護口罩認證要求:常見的個人防護口罩的歐洲標準是EN149,按照標準將口罩分為FFP1/FFP2和FFP3三個類別,需要滿足歐盟(EU)2016/425個人防護設備指令(PPE)的要求。
認證流程為:產品的型式試驗報告-技術文件評審-工廠質量體系審查-頒發CE證書-產品出口。
2、歐盟醫用防護口罩認證要求:醫用口罩對應的歐洲標準是EN14683,按照醫療器械法規2017/745/EU的要求。
1)醫用外科口罩產品按照一類器械進行管理。依據產品是無菌或非無菌狀態提供,認證模式有所差別。
a)非無菌方式流程:編制技術文件 -提供測試報告(可以提供熔噴布性能測試報告和無紡布的生物學報告)-編制DOC -指定歐盟授權代表并完成歐洲注冊。
b)無菌方式流程:滅菌驗證 -建立ISO13485體系 -編制技術文件 -提供測試報告(口罩本身的生物學、性能、無菌等測試報告-公告機構審核-獲CE證書 -指定歐盟授權代表并完成歐洲注冊。
2)普通醫用口罩流程按照一類器械進行管理:認證模式與上述醫用非無菌外科口罩一致。
出口歐盟企業小貼士:從目前整體情況來看,醫用外科無菌口罩如果之前沒有獲得公告機構的CE證書,現在臨時去申請周期太長。
相關出口的企業,可以找到國內一些權威第三方檢測認證機構進行協助認證檢測。作為全球專業權威的第三方檢測認證機構,倍通檢測是國內最早從事進出口商品檢測、產品認證服務的第三方檢測機構之一,主要致力于從事可靠性與環境試驗、電磁兼容檢測、安規檢測與能效、環保檢測、食品檢測、化學分析、驗廠驗貨技術咨詢等檢測認證業務,包括CCC認證、CE認證、FCC認證、RoHS檢測、EMC測試、CQC認證、UL認證、玩具檢測、無線產品檢測、電池類檢測、汽車VOC/ELV測試、材料可靠性測試等服務。疫情期間,通過線上線下協同發力,全天候24小時為各類產品出口工廠提供實時在線服務和技術服務,更高效及時地為您提供高質量檢測認證服務。